

8月18日晚間,國家醫保局網站公布了通過2023國家醫保目錄初審的藥物名單,并對公式情況進行了解讀。
根據公示結果顯示,2023年7月1日9時至2023年7月14日17時,共收到企業申報信息629份,涉及藥品(通用名,下同)570個。經審核,390個藥品通過初步形式審查。與2022年相比,申報藥品數量有一定增加。
值得注意的是多款高價熱門藥物在列,中國第一款獲批的CAR-T產品是復星凱特公司的奕凱達(阿基侖賽注射液);于2023年2月21日獲得中國國家藥品監督管理局批準,單藥用于治療既往接受過一種或一種以上抗HER2藥物治療的不可切除或轉移性HER2陽性成人乳腺癌患者的注射用德曲妥珠單抗(優赫得);其中,阿基侖賽注射液也曾出現在2021年的醫保目錄初審名單之中,但最終沒有進入醫保目錄。
醫保藥品目錄調整分為企業申報、形式審查、專家評審、談判競價等環節。一個藥品通過了初步形式審查,并不表示其已進入醫保目錄,僅代表經審核該藥品符合相應的申報條件,初步獲得了參加下一步評審的資格。
醫保局在解讀中表示,有一些價格較為昂貴明顯超出基本醫保保障范圍的藥品通過了初步形式審查,僅表示該藥品符合申報條件,獲得了進入下一個環節的資格。這類藥品最終能否進入國家醫保藥品目錄,還需要經嚴格評審程序,然后獨家藥品需談判、非獨家藥品需競價,只有談判或競價成功后才能被納入目錄。
以下為文件原文:
![]() 1.2023年國家基本醫療保險、工傷保險和生育保險藥品目錄調整通過初步形式審查的申報藥品名單.pdf
1.2023年國家基本醫療保險、工傷保險和生育保險藥品目錄調整通過初步形式審查的申報藥品名單.pdf

圖片來源:國家醫保局
根據2023年國家基本醫療保險、工傷保險和生育保險藥品目錄(以下簡稱國家醫保藥品目錄)調整工作安排,在相關部門的支持下,國家醫保局近期對申報藥品進行了初步形式審查,并對通過審查的藥品和信息進行了公示。現就有關工作情況解讀如下。
一、初步形式審查的意義
初步形式審查是對申報藥品是否符合當年國家醫保藥品目錄調整申報條件以及藥品信息完整性進行的初步審核。
按照《基本醫療保險用藥管理暫行辦法》,國家醫保藥品目錄調整實行企業申報制。國家醫保局根據當年的國家醫保藥品目錄調整工作方案,確定申報條件和要求,各申報主體自愿申報。對藥品申報資料進行初步形式審查,一方面可以確保申報的藥品符合申報條件,另一方面對申報資料的完整性、規范性進行審核,并根據工作需要就一些資料的真實性向有關方面進行核實,有利于保證提供給專家的信息更加準確完整。同時,為主動接受社會監督,確保形式審查結果準確,我們對通過初步形式審查結果的藥品和部分信息進行公示,歡迎社會各界提出寶貴意見和建議。
二、通過初步形式審查是否意味著已被納入國家醫保藥品目錄?
按照《基本醫療保險用藥管理暫行辦法》和《2023年國家基本醫療保險、工傷保險和生育保險藥品目錄調整工作方案》(以下簡稱《工作方案》),醫保藥品目錄調整分為企業申報、形式審查、專家評審、談判競價等環節,形式審查只是其中之一。一個藥品通過了初步形式審查,并不表示其已進入醫保目錄,僅代表經審核該藥品符合相應的申報條件,初步獲得了參加下一步評審的資格。
三、2023年國家醫保藥品目錄調整的企業申報和初步形式審查與去年相比有什么變化?
2023年7月1日9時至2023年7月14日17時,共收到企業申報信息629份,涉及藥品(通用名,下同)570個。經審核,390個藥品通過初步形式審查。與2022年相比,申報藥品數量有一定增加。
四、如何看待一些目前市場價格較為昂貴等明顯超出基本醫保保障范圍的藥品通過了初步形式審查?
自成立以來,國家醫保局堅決貫徹黨中央、國務院決策部署,始終牢牢把握基本醫保“保基本”的功能定位,堅持盡力而為、量力而行,實事求是地確定保障范圍;始終堅持穩健可持續,將醫保基金和參保群眾的承受能力作為目錄調整工作的基礎,通過準入談判等方式大幅降低獨家藥品的價格;始終聚焦群眾基本醫療需求和臨床技術進步間的平衡,提升可及性,維護公平性。有一些價格較為昂貴等明顯超出基本醫保保障范圍的藥品通過了初步形式審查,僅表示該藥品符合申報條件,獲得了進入下一個環節的資格。這類藥品最終能否進入國家醫保藥品目錄,還需要經嚴格評審程序,然后獨家藥品需談判、非獨家藥品需競價,只有談判或競價成功后才能被納入目錄。
五、本次公示后將會如何開展工作?
下一步,我們將根據公示期間收到的反饋意見,進一步核實相關信息,確定最終通過形式審查的藥品范圍,并向社會進行公布。隨后,我們將按照《工作方案》要求推進專家評審、談判競價等后續工作。

圖片來源:國家醫保局
2023年國家基本醫療保險、工傷保險和生育保險藥品目錄調整通過初步形式審查的申報藥品名單
一、目錄外西藥和中成藥
藥品申報條件:
1.2018年1月1日至2023年6月30日(含,下同)期間,經國家藥監部門批準上市的新通用名藥品。但僅因為轉產、再注冊等原因,單純更改通用名的藥品除外。符合本條件的新冠抗病毒
用藥可按程序申報。
2.2018年1月1日至2023年6月30日期間,經國家藥監部門批準,適應癥或功能主治發生重大變化,且針對此次變更獲得
藥品批準證明文件的通用名藥品。
3.納入《國家基本藥物目錄(2018年版)》的藥品。
4.2023年6月30日前經國家藥監部門批準上市,納入衛生健康委等部門《首批鼓勵研發申報兒童藥品清單》《第二批鼓勵研發申報兒童藥品清單》《第三批鼓勵研發申報兒童藥品清單》以及《第一批鼓勵仿制藥品目錄》《第二批鼓勵仿制藥品目錄》
的藥品。
5.2023年6月30日前經國家藥監部門批準上市,說明書適應癥或功能主治中包含有衛生健康委《第一批罕見病目錄》所收錄罕見病的藥品。












圖片來源:國家醫保局
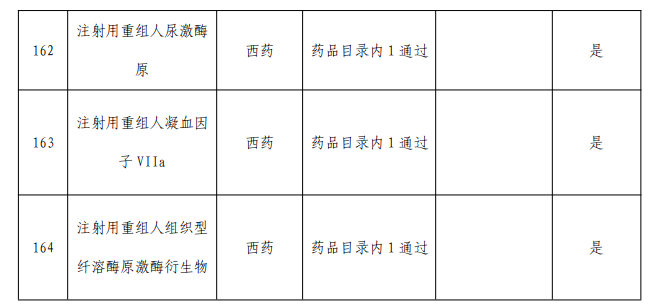
二、目錄內西藥和中成藥
藥品申報條件:
1.2023年12月31日協議到期,且不申請調整醫保支付范圍的談判藥品。
2.2018年1月1日至2023年6月30日期間,經國家藥監部門批準,適應癥或功能主治發生重大變化,申請調整醫保支付范圍的藥品。
3.2023年12月31日協議到期,適應癥或功能主治未發生重大變化,因適應癥或功能主治與醫保支付范圍不一致,主動申請調整支付范圍的談判藥品。










圖片來源:國家醫保局
來源:藥智網